原子の構造と電子が波と考えられる理由、原子量と同位体
更新日:
物質をどこまでも細かく分解できる魔法の機械があったとします。
この魔法の機械で、物----例えば、小さな鉄球----を細かく細かく分解していくと、「原子」に辿り着きます。
原子の大きさは、10ー10mというイメージできない小ささです。
原子と野球のボールを大きなコピー機に載せて、原子を野球のボールの大きさにまで拡大すると、野球のボールは地球の大きさになってしまいます。
小さな原子ですが、大きさの殆どは電子雲で出来ています。
電子雲というのは電子が含まれている部分で、殆ど質量がありません。
そして、電子雲に濃淡はありますが、雲の何処に電子あるという訳ではありません。
観測者が電子を見たり測定したりしない限り電子は“波”として振舞っています。
波なので波の中に電子があるのは確かですが、波のどこに電子があるかは判りません。
電子が波と考えられる理由
子供の頃、物質は原子で出来ていて、その原子は、太陽の周りを回る惑星のように原子核の周りを幾つかの電子が回っているというイメージを抱いていました。
私が小学生時代に工作で作った木製本立ての側面に、原子核の周りに2個の電子が回っている画を描いたのを今でも覚えています。 (電子が2個ですから、幼い知識でヘリウムをイメージしていたのでしょうか)
このようなイメージ図はわかりやすいので現在でも使われますが、少し勉強し出すと、原子というのはそう簡単なものでは無いことが解ります。
原子の中心にある原子核は、プラスの電気を帯びた陽子と、電気的には中性の中性子で構成されています。 原子核を構成する陽子と中性子は、核力と言われる力で1つの塊になっています。 陽子や中性子の極々近くには中間子と言われる粒子(素粒子)が存在し、中間子が陽子や中性子の間を出たり入ったりして非常に強い力で結び付けています。 中間子は、質量(陽子と電子の中間の質量)を持っているので陽子や中性子から離れられません。そのために核力は電子や隣接の原子核の間では働きません。
核力は原子力発電の熱源として利用されています。
電子を粒子と考えられない理由
最も難解なのは、原子核の周囲にある電子の存在です。 電子が粒子なら太陽の周りを回っている惑星のような感じかも知れませんが、電子を粒子と考えると、 電子は原子核に引き寄せられて陽子に付いて消えてしまいます。 燃料を使い果たした人工衛星の高度が下がって大気圏に突入するようにです。
電子が動くと電流になりますが、原子核の周りを電子が回っていれば電流は変化し、電流の変化は電磁波を生じさせます。 電磁波は100%エネルギーですから、電磁波を放出することは電子がエネルギーを失うことなので、 やがて、電子は燃料を使い果たした人口衛星状態になってしまいます。
しかし、現実には電子は原子核につくことはありません。また、電子が粒子なら原子内の電子は階段状のエネルギー値しか持たないという話も出来なくなります。 人工衛星の高度が自由に決められるのと同じです。
電子を波と考えると都合がよい理由
今度は、電子は波と考えてみます。波には進行波と定常波があります。 進行波は、たとえば波の振幅値の最も大きい部分を見ていると、その部分が一方向に移動するものです。
進行波が損失無く反射して、進行する波とその反射した波が重なり合って移動していないように見える波が定常波です。
ギターなどの弦楽器の弦の振動は、弦の両端が留められているので両端の振幅値は常にゼロの定常波となります。
定常波では進行波によって移動したエネルギーが逆向きの進行波によって返ってくると考えられるのでエネルギーは失われません。
原子内の電子は、定常波状態で原子核を取り囲んでいると考えます。
定常波のときはエネルギーを失わないので電子が原子核に引き寄せられて付くことはありません。 また、弦楽器の弦の振動で解るように、両端が留められている(定まった定常波になる条件がある)とすれば、半端な波長はとれなくなります。
波長の大きさとエネルギーの値は関連しているので、電子は半端なエネルギーを持てなくなり、階段状のエネルギー値を持つようになります。
また、波であるためには最低でも振幅の変化する部分が一つは必要なので、 電子のエネルギーがゼロになることはありません。
なお、原子核から解放された電子は自由な大きさのエネルギーを持つことが出来ます。
電子が原子内の何処にあるか? という問題も、電子を粒子と考えて探した場合には、波の振幅の絶対値の大きい所に電子があるように思えるだけです。
また、電子雲の形は上図のように卵の殻のようになっている原子がある一方、特異な形をしている原子と量子的に決まった形をしています。
この電子雲の中心に極小さいのに原子の質量の99.9%以上を占めている重い原子核があります。
原子核の大きさは原子全体の大きさより4桁小さくて10-14mなので、 直径100mの巨大綿菓子(電子雲)の中心部にパチンコ玉が入っている図を想像してみてください。
ところで、電子雲の中に存在する“電子”はマイナスの電気を帯びています。
水素原子の電子雲の中には電子が1個あり、電子1個の電気の量を“-e”で表します。
水素原子は電子1個なので電子雲全体の電気量は-eです。
そして、原子全体としては電気的に中性なので、電子雲が持っているマイナスの電気量にみあったプラス電気を原子核が持っていることになります。
原子力発電に使われるウランの電子は92個、電子雲全体の電気量は-92eなので、ウラン原子核が持っている電気量は+92eとなります。
電子が持っているエネルギー
先に、電子は雲状態で存在すると書きましたが、ここでは原子核の周りを幾つかの電子が回っているというモデルで説明します。
そして、 解りやすくするために原子を太陽系に喩えてみます。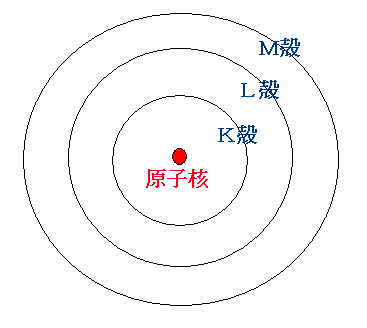
太陽に一番近い所を回っている水星の軌道を原子ではK殻、 金星の軌道を原子ではL殻、地球の軌道を原子ではM殻、次はN殻、・・・・
というように原子では原子核から近い順にLからアルファベット順に名前が付けられています。
そして、これらの殻には量子数nがついています。
量子数nというのは「量」を表す数で、K殻はn=1、L殻はn=2、M殻は3、N殻はn=4、・・・
となっていて、1.5とか、2.1という数はとりません。
このように半端の数をとらないという点が重要です。
また、「量子」というものが存在する訳ではありません。考えるのに都合の良いように「量」で区切っているだけです。
電子が持っているエネルギーは、原子核と電子の間に働いている静電エネルギーと電子の運動エネルギーの和です。
このエネルギーを考えるときには、静止している自由電子(どの原子にも属していないで自由に移動できる電子)が持っているエネルギーを E=0 として基準にします。
電子殻(K殻、L殻、M殻、・・・)に入っている電子が持つエネルギー$E_{n}$は $$E_{n} = - \frac{E}{n^2} $$ で表されます。
nは1,2,3,4、・・・という自然数なので、原子核から遠い電子ほど大きなエネルギーを持っています。
それぞれの電子殻に入ることが出来る電子の数Nも量子化されて表され、 $$ N = 2n^2 $$ となっています。
K殻には2個、L殻には8個、M殻には18個、・・・となります。
話はそれますが、例えばM殻には18個の電子が入れるのに電子が10個しかない原子の場合は不安定なので隣に存在する原子の電子を共有したがります。
この働きは原子同士を結合させるので“て共有結合”と言い、同種の元素同士の共有結合もあれば異種の元素での共有結合もあります。 また、共有結合は接着剤に使われる他に、物と物とを密着させたときに生じる摩擦の大きさにも関係します。
それから、電子は $$ E_{n} = \frac{E}{n^2} $$ で示される値しか持つことが出来ないので、 例えば、K殻にある電子がよりエネルギー値の大きいL殻に移動するとき(励起)には、 L殻とK殻の持つエネルギーの差だけ外部からエネルギーをもらわなければなりません。
光などの電磁波からエネルギーをもらう場合には、電磁波は波長によって持っているエネルギーの大きさが決まっているので、 電子を励起したエネルギーに等しい波長の電磁波が吸収されます。
可視光領域にあったなら吸収された波長(色)が反射されないので、その色の補色がその物質の色として影響を与えます。
逆に例えばL殻からエネルギー値の小さいM殻に移動するときには、余分なエネルギーを放出します。
自然界では流星の光などに見られますが、人為的に電子を励起させて可視光として放出させると発光ダイオード(LED)などになります。
原子量と同位体
中性子の数は基本的には陽子と同数ですが、陽子より多いものが存在します。
電子の質量は、先に触れましたように陽子や中性子より4桁も小さいので、原子の質量は、陽子と、陽子とほぼ同じ質量の中性子の数で決まります。 このため、陽子の数で決められている原子番号が同じでも中性子の数が多いと質量が大きくなり、陽子の数(原子番号)が同じで質量が違うものを同位体と呼びます。
原子核は下図のように、プラス電気を持った陽子と電気的には中性の中性子から出来ています。
陽子の数は電子雲が持っている電気量で決まりますが、中性子の数は同じ物質(元素)でも違います。
例えば、水素の場合は電子雲が持っている電気量が電子1個分の -eなので陽子も1個。
ところが、中性子は0個のもの、1個のもの、2個のものがあります。
中性子が異なるものは同位体といわれるので、水素の場合は“水素の同位体”と言います。
自然界に存在する水素の99.98%は中性子の数が0のもので、“軽水素”
次に多いのが中性子1個のもので“重水素”
殆どありませんが中性子2個のもので“三重水素”と言います。
元素記号の表記方法
元素記号の表記は次のようにします。
中性子は陽子と同じ質量があるので中性子の数が多いほど重くなります。
「原子量」と呼ばれるものは原子核の質量を陽子と中性子の数で表したもので、 中性子の数が異なる同位体の原子の場合の原子量は、同位体の加重平均して求めます。
加重平均というのは重要な要素とそれ以外の要素に重み(差)をつけて平均を求める方法です。
水素の場合では、全体の99.98%が軽水素なのでこの同位体を重く見て計算する訳です。
一般的には、x、y、zと3種類あった場合には、(ax+by+cz)÷(x+y+z)で求められます。
但し、a,b,cは重みです。